导语
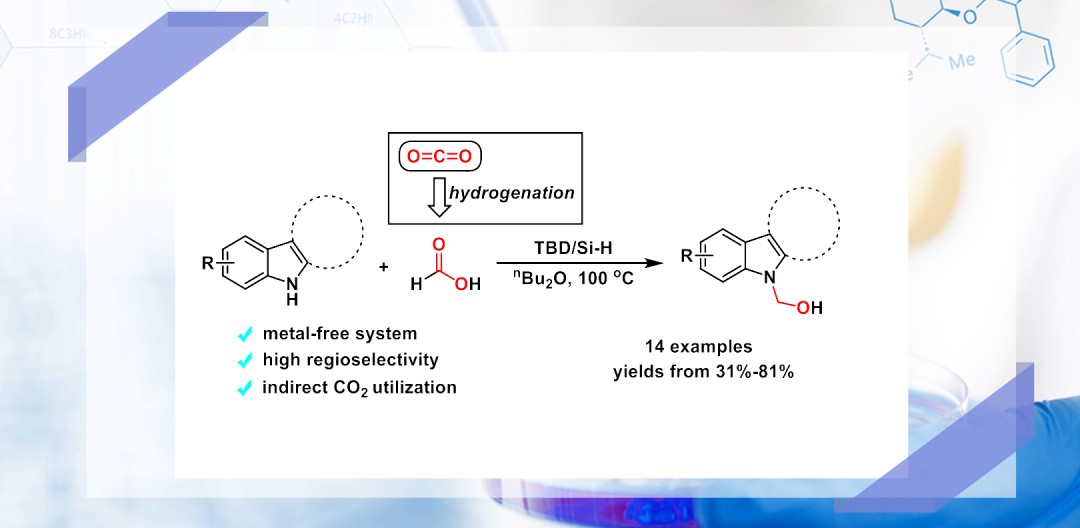
近年来,吲哚的N-烷基化反应是合成具有药物活性的吲哚活性分子的重要途径。由于吲哚3-号位的亲核性比氮原子强,因此吲哚的N-烷基化反应具有一定的难度。目前用于实现吲哚的N-烷基化主要包括羰基化合物(醛和酮)的还原胺化;烷基卤代物、亚胺、腙和碳酸酯类化合物的亲核取代反应;醇类化合物的“借氢”策略;此外,硼酸、双铋试剂、卡宾、二酰基过氧化物以及烯烃等也可以用于吲哚的N-烷基化反应。近日,南开大学何良年教授课题组采用甲酸作为烷基化试剂,实现了TBD促进的以甲酸作为烷基化试剂的吲哚N-羟甲基化反应,为间接利用CO2提供了新思路,相关成果发表在J. Org. Chem.(DOI: 10.1021/acs.joc.1c02831)。
图1. TBD促进甲酸参与的吲哚N-羟甲基化反应
(来源:J. Org. Chem.)
何良年教授课题组简介

何良年教授课题组现有研究人员15人,包括教授1名,专任教师3名,博士研究生5名,硕士研究生6名。课题组专注于二氧化碳资源化利用、绿色化学、生物质能等领域研究,在二氧化碳化学及可再生碳基能源化学领域取得了系列创新成果,编著了《二氧化碳化学》与《绿色化学基本原理》,受到关注与好评,推动了二氧化碳化学领域的发展。在重要学术刊物如Angew. Chem. Int. Ed、Energy Environ Sci.、J. Mater. Chem. A、Research、Chem. Mater.、Sci. Bull.、Green Chem.、ChemSusChem.、Chem Commun.、Org. Lett.、Chem Eur J.、Adv Synth Catal.、J. Org. Chem.、J. Catal.等学术刊物上发表学术论文280余篇。撰写英文专著1部、中文书籍3部以及英文书籍章节20部(ACS book series, John Wiley & Sons, Springer, Elsevier, CRC Press Taylor @ Francis),申请(获得)授权中外专利30项。更多详情请点击课题组主页查看:
http://greenchem.nankai.edu.cn/。
何良年教授简介

何良年,南开大学教授,博士生导师。1988年9月至1991年6月在华中师范大学攻读硕士学位,师从我国著名有机磷化学家张景龄教授;1993年9月至1996年6月攻读博士学位期间,在陈茹玉院士指导下从事有机磷杂环化学研究,1996年获理学博士学位。1996年10月-1998年10月,在武汉大学做博士后,从事高分子药物控制释放研究;合作导师:卓仁禧院士。1999年3月-2003年3月,在日本产业技术综合研究所(National Institute of Advanced Industrial Science and Technology,日本筑波)做博士后(NEDO fellow),从事基于二氧化碳资源化利用主导的绿色化学研究;合作导师:Toshiyasu Sakakura 教授。1998年入选湖北省高等学校跨世纪学术带头人。2003年回国,被聘为南开大学教授,2004年4月被批准为博士生导师。2009年楚天学者特聘教授,2011年入选英国皇家化学会Fellow(FRSC)。2016受邀担任Bentham科学出版社大使。受邀在学术会议上作报告80余次。曾获天津自然科学奖、军队科技进步奖,2018年获得南开大学第八届“良师益友”奖。2019年参与发起并组织的中国化学会首届二氧化碳资源化利用大会,获中国化学会优秀学术交流组织奖(2019年)。2014-2020年入选中国高被引学者(Most Cited Chinese Researchers, Elsevier)榜单,入选英国皇家化学会Top 1% 高被引中国学者榜单。
现任Green Chemistry and Sustainable Technology (Springer) Series Editor、Current Organic Synthesis主编(2015-2021)、Journal of CO2 Utilization(Elsevier)、 ChemistryOpen(Wiley)、科学通报、Current Opinion in Green and Sustainable Chemistry(Elsevier)、Mini-review in Organic Chemistry、Green Chemical Engineering等多种学术期刊编委,中国化学会绿色化学专业委员会委员,中国化工学会离子液体专业委员会委员,“低碳催化与二氧化碳利用”国家重点实验室学术委员,离子液体清洁过程北京市重点实验室学术委员,广东省低碳化学与过程节能重点实验室学术委员会副主任,油脂分子构效湖南省重点实验室学术委员会委员,天津市工业尾气资源综合利用技术工程中心技术专家,加拿大国家自然科学与工程技术基金、欧盟自然科学基金、德国科学基金、奥地利、克罗地亚、比利时等国家自然科学基金等的海外评审专家,为Wiley、ACS出版公司的书评专家。
前沿科研成果
有机碱TBD促进的吲哚N-羟甲基化反应
吲哚N-烷基化反应是药物活性的吲哚活性分子制备重要方法之一。由于吲哚3-号位的亲核性比N原子强,因此吲哚的N-烷基化反应及其产物的选择性调控具有挑战性。
还原胺化策略是利用羰基化合物作为烷基化试剂实现吲哚的N-烷基化反应。例如,使用五氟苯基硼为催化剂,以羧酸作为烷基化试剂的吲哚N-烷基化,此时吲哚骨架会被还原。近来,使用酮类底物作为烷基化试剂,可以通过去芳构化-芳构化的过程实现吲哚N-烷基化反应。在这个过程中,吲哚首先还原为吲哚啉,随后恢复芳构化生成吲哚N-烷基化产物。吲哚啉的生成可以降低3-号位的亲核性,同时增强N原子的反应活性。醛类底物也可以用于该类转化,然而底物受限于3-号位预先官能团化的吲哚衍生物。此外,使用烷基卤代物、亚胺、腙和碳酸脂作为烷基化试剂,在碱或者碱性催化剂的条件下可以通过亲核反应实现吲哚N-烷基化反应。通过“借氢策略”,使用醇类化合物同样可以实现该类转化。此外,硼酸、双铋试剂、卡宾、二酰基过氧化物以及烯烃也可以用于吲哚的N-烷基化反应。
何良年教授课题组长期致力于CO2化学基础研究及资源化利用途径开发,其中以甲酸作为转化的桥梁,可认为是CO2的间接利用方式之一。早期,该课题组报道了铁催化的甲酸对于芳胺化合物的甲基化反应。考虑到还原胺化的高效性,该课题组的本次工作实现了甲酸对于吲哚的N-羟甲基化反应(图表1)。由于CO2的催化氢化可以方便地合成甲酸,因此,本工作可看作是对于CO2的间接利用方法在制备高附加值产品如吲哚衍生物中的应用。该方法反应条件温和、产物选择性高、具有良好的底物适用性,发表在有机化学专业杂志J. Org. Chem.(DOI: 10.1021/acs.joc.1c02831),博士生黄文斌是论文的第一作者。

图表1. TBD促进甲酸参与的吲哚N-羟甲基化反应
(来源:J. Org. Chem.)
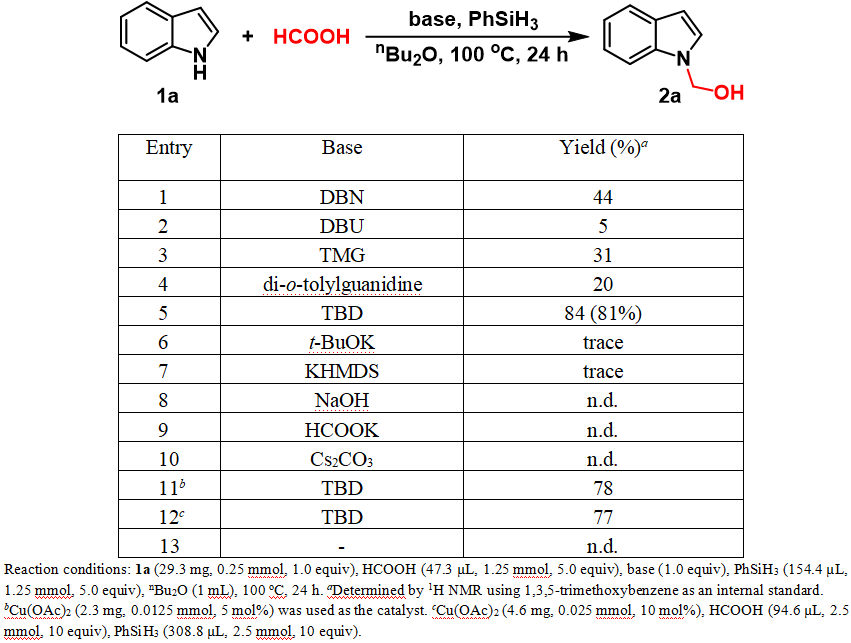
首先,作者选用吲哚为模板底物,DBN作为碱,苯硅烷为还原剂,在100 ℃条件下反应24 h实现了甲酸对于吲哚的N-羟甲基化反应。并对一系列碱进行了筛选,有机碱对于该过程是有效的,例如DBU、TMG、邻二甲苯基胍也能促进该过程,但收率较低。使用更强的有机碱TBD,可以获得84%的核磁共振氢谱收率(分离收率:81%)。在反应中,碱的作用可能是起到夺取吲哚氮原子的质子,从而生成较为稳定的吲哚氮负亲核试剂。然而,对于无机碱t-BuOK、KHMDS或者是位阻更小的无机碱NaOH、KOAc和Cs2CO3,都不能很好地促进这个反应。控制实验表明,加入催化量的Cu(OAc)2反而会使收率降低,同时证明当量的TBD是反应顺利进行所必需的。
表1. 碱的筛选
(来源:J. Org. Chem.)
随后,作者对常用的氢硅烷和溶剂进行了筛选,表2的结果表明,氢硅烷对于反应有显著的影响,使用Ph2SiH2、Et3SiH、(EtO)3SiH和(MeO)2SiMeH效果很差,使用PMHS可以获得中等的收率。此外,还考察了溶剂效应,极性溶剂如THF、DMSO和CH3CN会完全抑制反应的进行;无溶剂条件下,反应基本不发生。此外,增加吲哚的浓度,反应收率不会提高。随后,作者精细调控了甲酸和氢硅烷的用量,选择甲酸和氢硅烷的用量为5 equiv具有较好的收率。最终,通过一系列的条件优化,确定最优反应条件为:吲哚1a(0.25 mmol,1 equiv),甲酸(1.25 mmol,5 equiv),有机碱TBD(0.25 mmol,1 equiv),苯硅烷(1.25 mmol,5 equiv)作为还原剂,在100 ℃下反应24 h后可获得最优分离收率81%(entry 5, 表1)。
表2. 氢硅烷和溶剂的影响

(来源:J. Org. Chem.)
作者对羟甲基化反应的底物适用性进行了考察,从图表3的结果可以看出,对于含有各种取代基的吲哚或咔唑底物(2a~2d, 2f~2o),都能以较好的收率和选择性获得N-羟甲基化产物。但是,当吲哚7位有甲基取代时,反应基本不发生,可能是因为空间位阻阻碍了羟甲基化路径。供电子取代基-OMe位于吲哚4位的底物,可获得62%的分离收率(2f)。当吲哚骨架上有吸电子取代基,例如-F、-Cl和-Br,反应也可以顺利进行(2g~2j,31%~80%)。当吲哚2,3位有脂肪族并环时,能以中等的收率生成相应的目标产物(2k~2m,42%~58%)。更进一步,该合成策略对于咔唑底物而言同样适用,例如咔唑以及-BPin取代的咔唑底物都能够兼容,生成相应的N-羟甲基化产物2n和2o,产物收率中等。
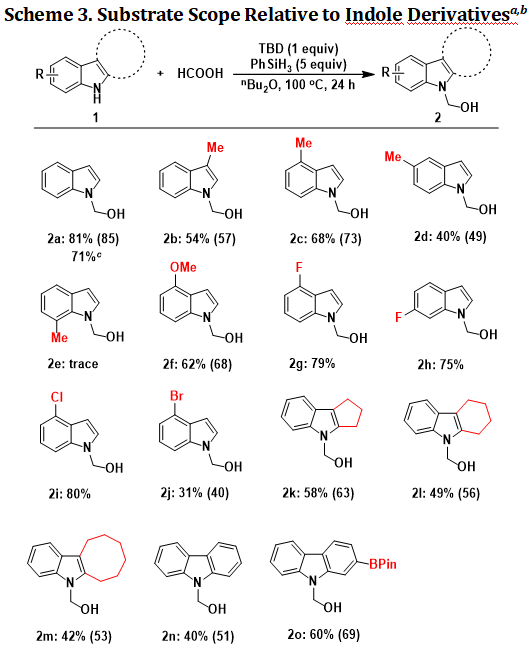
aUnless noted otherwise, all the reactions were performed with indole derivative 1 (0.25 mmol, 1.0 equiv), HCOOH (47.3 µL, 1.25 mmol, 5.0 equiv), TBD (34.8 mg, 0.25 mmol, 1.0 equiv), PhSiH3 (154.4 µL, 1.25 mmol, 5.0 equiv), nBu2O (1 mL), 100 ℃, 24 h. bIsolated yield, the conversion of starting material was given in parentheses. cYield for 1 mmol scale reaction.
图表3. N-羟甲基化反应的底物适用范围
(来源:J. Org. Chem.)
作者还通过对反应体系的气相组成进行分析,发现体系中有H2产生,推断可能是甲酸与氢硅烷反应生成甲酸硅酯。此外,通过核磁共振以及红外光谱技术对甲酸硅酯中间体进行了确认。为了证明反应经历甲酰胺中间体的历程,作者选用甲酰基咔唑作为模板底物,在标准条件下进行反应,以45%的收率生成了羟甲基化产物,同时伴随咔唑的生成,收率为51%,从而证明了咔唑的甲酰化过程是可逆的。
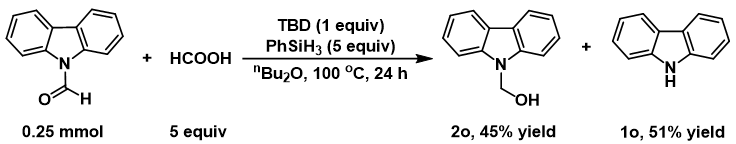
图表4. 控制实验
(来源:J. Org. Chem.)
基于本文的研究、控制实验和文献报道,作者提出了TBD促进甲酸参与的吲哚N-羟甲基化反应可能的反应机理。首先,在有机碱TBD的作用下,吲哚N-H转化为吲哚氮负离子A;与此同时,甲酸与苯硅烷会生成甲酸硅酯中间体B,同时伴随着大量氢气产生;随后,吲哚氮负离子A与甲酸硅酯B反应生成甲酰胺中间体C;接着,甲酰胺中间体C被进一步还原为中间体D;最后,通过NH4F处理可以生成羟甲基产物2a。
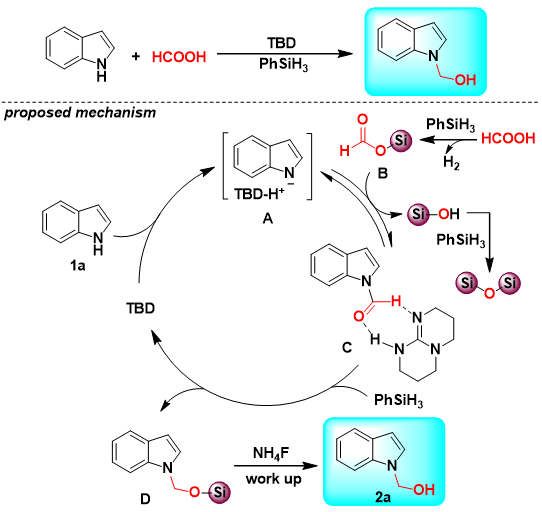
图表5. 羟甲基化可能的机制
(来源:J. Org. Chem.)
总结:
该方法成功实现了TBD促进甲酸对吲哚N-H的羟甲基化反应,具有良好的底物适用性和选择性。该反应为甲酸的高值转化提供了新方案,为CO2的间接利用提供新途径,拓展了二氧化碳资源化应用领域。
原文(扫描或长按二维码,识别后直达原文页面):