

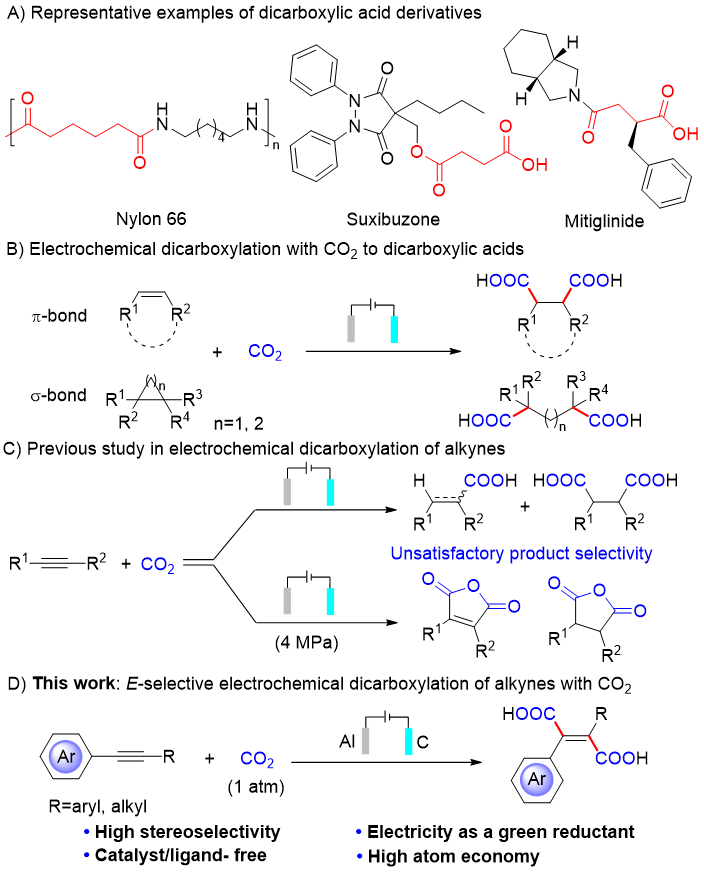
背景



电羧化为生产有价值的羧酸及其衍生物提供了一种高效、可持续的方法,在制药、精细化学品和聚合物行业有着广泛的应用。炔烃与CO2的电化学羧化反应已有报道,但在适用底物和产物选择性方面还面临挑战。值得注意的是,炔烃直接二羧化生成α、β-不饱和二羧酸(这是大量药物和功能聚合物的重要基团)在这一领域更具挑战性和前景。目前,炔烃与CO2的立体选择性电羧化生成E-丁烯二酸的方法仍未实现。



要点



4. 该方法是第一个用无过渡金属和无外加还原剂的电还原羧化方法制备E-选择性取代丁烯二酸的实例。


图文


(图片来源:Org. Lett.)
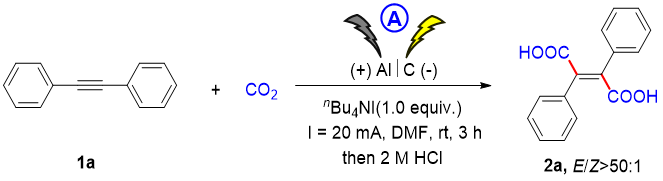
本文以1,2-二苯基乙炔为模板底物,在仔细优化反应条件后,以nBu4NI为电解质,铝板为阳极,石墨棒为阴极,在DMF中以恒定电流(20 mA)进行反应,得到了所需的二羧酸2a,分离产率为92%,且具有显著的E-区域选择性(E/Z> 50 : 1)。
(图片来源:Org. Lett.)
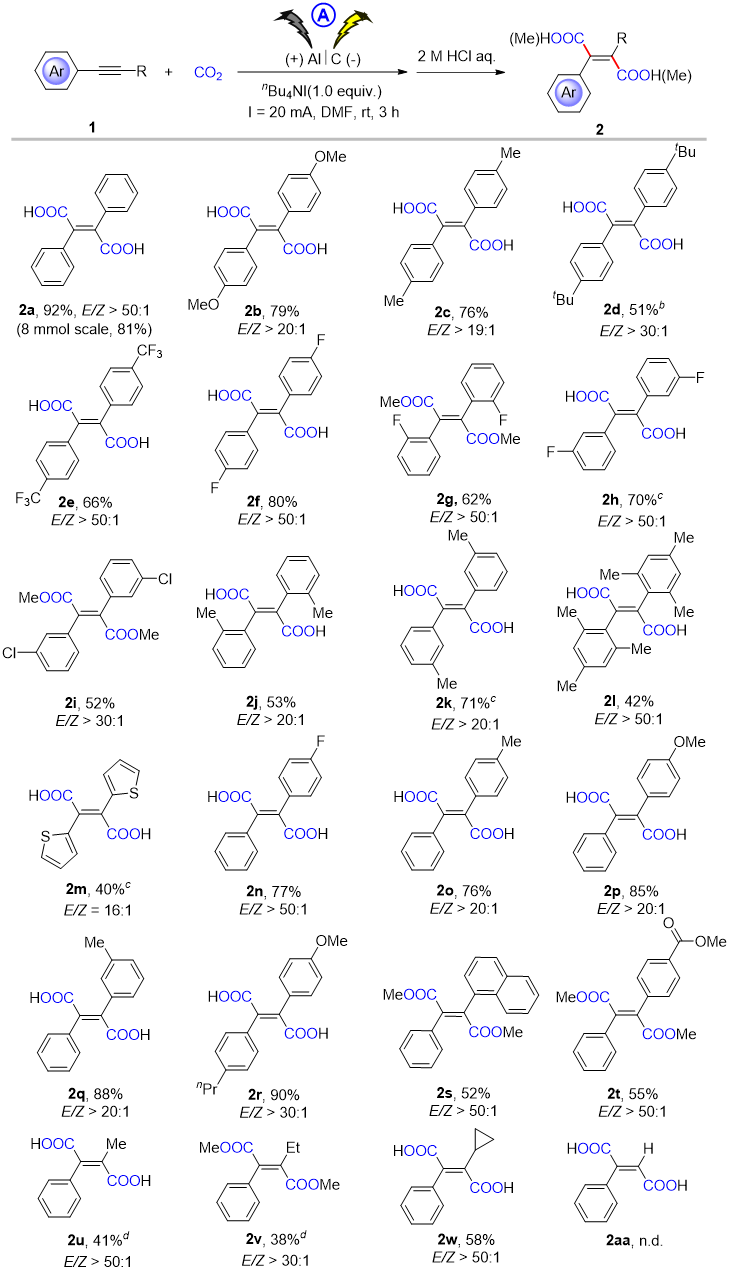
在获得最佳反应条件后,进一步研究此方法对各种炔烃的适用性。对称的芳基炔烃的二羧化反应进行得很顺利,生成的E-丁烯二酸产量适中(2a-2m)。含噻吩的富电杂芳香族炔烃(2m)也能进行这种转化,尽管其E/Z比率较低(16:1)。对于非对称的炔烃,带有各种氟取代基、甲基、甲氧基和正丙基的二芳基炔烃衍生物可以成功地参与羧化反应,以良好的产率提供所需的丁烯二酸衍生物(2n-2r)。值得注意的是,带有酯基的芳基炔烃(2t)也可以顺利进行二羧化,显示出了良好的官能团兼容性。此外,带有烷基末端的炔烃也能很好地生成相应的二羧酸(2u-2w)。
Scheme 3. Proposed Reaction Mechanism for Butenedioic Acids Formation
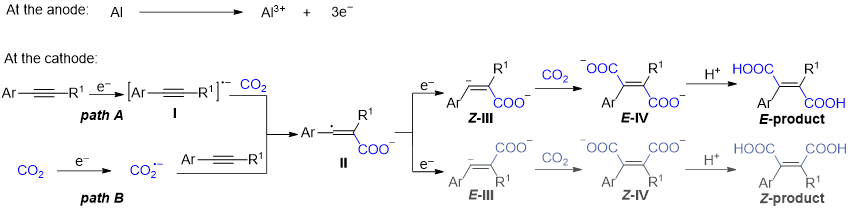
(图片来源:Org. Lett.)
根据实验结果和相关研究,提出了合理的反应机制。在阴极,根据底物的还原电位,可能存在两种不同的反应途径。对于还原电位比CO2更正的底物,芳基炔烃首先通过单电子转移被还原生成自由基阴离子中间体I,然后与CO2快速反应生成羧基碳自由基中间体II(路径A)。另一方面,对于比CO2难还原的底物,CO2首先被还原,产生CO2自由基阴离子,随后与炔烃发生自由基加成反应,从而生成中间体II(路径B)。中间体II进一步被还原,形成羧基化的碳阴离子中间体III,然后对CO2进行亲核攻击,得到中间体IV。最后,通过质子化得到所需的二羧酸。在阳极,铝板发生氧化,形成铝离子作为反离子,以稳定阴离子中间体。DFT计算解释了立体选择性的决定性因素。


总结展望


南开大学何良年课题组报道了一种新型的电化学策略,即通过CO2对炔烃进行半还原二羧化反应,从而高效地制备出α,β-不饱和二羧酸类化合物。该策略具有反应条件温和、立体选择性高、底物适用性广、步骤和原子经济性高等特点。因此,该方案为合成E型不饱和二羧酸提供了一种清洁环保的方法,在有机合成、药物化学和材料科学领域具有巨大的应用潜力
